蛋白质寡聚化或由其组装成稳定的多亚基复合物是很常见的蛋白质功能性构型。 这种寡聚化功能性构型,在蛋白质家族甚至超家族中常常是其保守性特征。 但目前对于寡聚结构保守及进化的相关机理,特别是在非协同酶超家族作用于小分子底物的情况下的机理,我们仍不清楚。 一直以来,经常有研究揭示寡聚化有助于稳定功能性蛋白质复合物的结构。 然而,目前通过寡聚相互作用来稳定蛋白质结构的特定物理化学机制和结构特征仍没有得到充分的表征。
江南大学徐岩课题组前期在近平滑假丝酵母中发现了短链脱氢酶/还原酶的同工酶 (S)-羰基还原酶(SCR、SCR1、SCR2和SCR3)序列,并对该同工酶展开了一系列的结构和功能研究。(S)-羰基还原酶在溶液中以四聚体形态存在,并且能够催化潜手性酮生成手性醇。前期该课题组主要围绕(S)-羰基还原酶的三级结构与功能关系展开研究。
近日,江南大学徐岩教授课题组与哥伦比亚大学John F. Hunt教授课题组在 EMBO J杂志上联合发表了短链脱氢酶/还原酶四聚体相互作用维持蛋白活性位点结构的相关研究 Oligomeric interactions maintain active-site structure in a non-cooperative enzyme family,揭示了短链脱氢酶/还原酶四聚体相互作用维持蛋白活性位点结构。

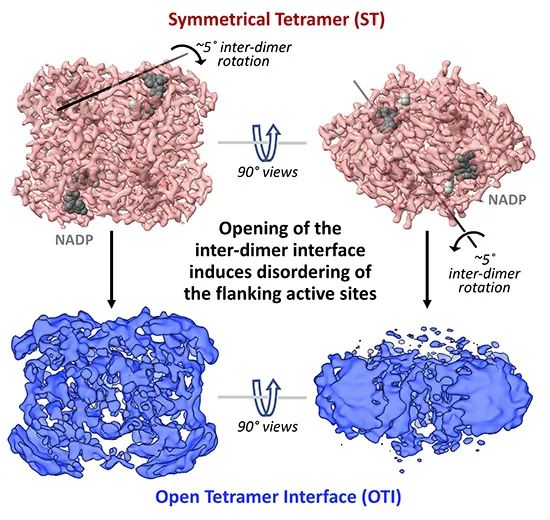
图1. SCR冷冻电镜样品中对称型四聚体和不对称型四聚体结构的比较。对称型四聚体界面平衡的破坏引起了活性位点侧翼序列结构的扰乱。
结合多种实验方法,其中包括X-射线晶体衍射学和低温电子显微镜 (cryo-EM)技术,研究人员证明了短链脱氢酶/还原酶超家族中保守的四聚体界面直接稳定了活性位点的结构,而这四聚体界面也是维持活性位点天然构象的必要条件。短链脱氢酶/还原酶超家族成员的系统发育比较表明该家族成员需要更长的氨基酸序列来维持单个亚基的等效活性位点结构,因此寡聚化通过降低生物合成酶的代谢成本来增强该酶的进化适应性。此外,该研究提供了一系列证据,表明通过寡聚化稳定酶的活性位点结构很有可能增强其进化适应性。研究人员发现具有不同特异性的SCR和SCR2可以形成异源四聚体,且它们的酶动力学数据表明寡聚化可以使给定的代谢流合成的产物产生多样化的功能。基于寡聚相互作用稳定活性位点结构的理论,该研究还发现SCR四聚体界面结构的扰动可以改变该酶的特异性,为酶活性的进化提供新的途径。由于较大的寡聚化界面的表面积提供了额外的范德华力和氢键作用力,因此该区域增强了蛋白结构对氨基酸替换的耐受性;即便单个亚基的折叠稳定性降低,寡聚化也能增强或多样化酶活性,因此该研究的一系列发现表明寡聚化结构策略使代谢效率和进化适应性方面产生协同增益作用。
这一研究不仅揭示了四聚体界面是维持SCR活性位点天然构象的必要条件,而且建立了研究寡聚相互作用如何增强进化适应性并维持其广泛的系统发育保守性的基本结构和物理化学原理。这些发现将有助于指导寡聚酶的从头设计,包括结合不同活性的异寡聚酶。
江南大学张荣珍教授和徐岩教授为本文的共同通讯作者,该工作主要由江南大学和纽约哥伦比亚大学(John F. Hunt课题组)联合培养的博士研究生李尧慧完成,纽约哥伦比亚大学的王驰博士,Farhad Forouhar博士和Oliver B. Clarke博士等参与了部分工作,伦斯勒理工的Gaetano T. Montelione教授和公牛大学的Thomas Szyperski教授也参与了该项目的指导。
原文链接:
https://www.embopress.org/doi/abs/10.15252/embj.2021108368


